ОПРЕДЕЛЕНИЕ
Белки - это высокомолекулярные соединения. Их условно можно отнести к группе полимеров.
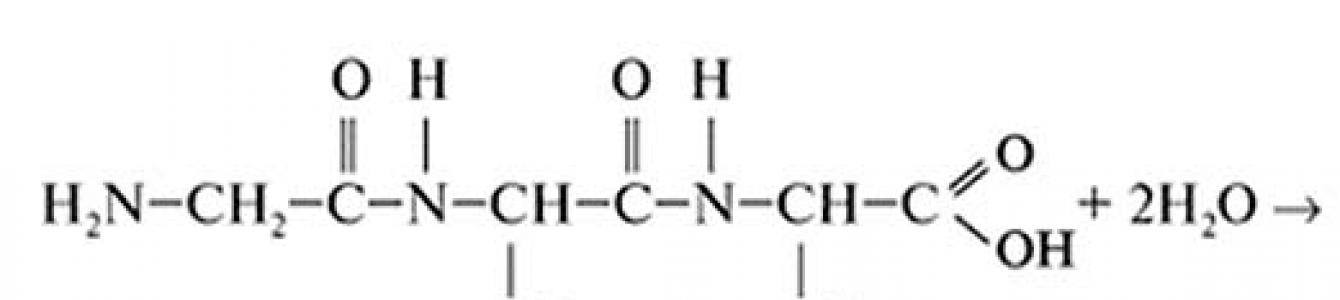
Мономерными звеньями белков выступают пептиды, которые состоят из аминокислот. Если вещество содержит более, чем 100 аминокислотных остатков его классифицируют как протеин, менее 100 - это ещё пептид. Образование белков (пептидная связь) схематично можно изобразить следующим образом:
Гидролиз белков
Белки способны частично гидролизоваться. Если представить, что гидролиз протекает до конца, т.е. полностью, то в качестве продуктов реакции получается смесь аминокислот. Кроме этих веществ в растворе после гидролиза были найдены углеводы, пиримидиновые и пуриновые основания, ортофосфорная кислота. Гидролиз белков протекает при определенных условиях: кипячение в растворе кислоты или щелочи.
Если в составе белков имеются амидные связи за счет наличия аминокислот с разветвленными боковыми радикалами, создающими стерические препятствия, как например в лейцине или валине, то гидролиз невозможен.
Если белок распадается на составляющие в щелочной среде, то гидролиз проводят в кислой и наоборот.
Условно уравнение реакции гидролиза белков можно записать как:

Для чего нужен гидролиз белков?
Поскольку белки являются высокомолекулярными соединения, то они могут плохо восприниматься организмом, так как любой продукт питания, растительного или животного происхождения имеет в составе белки. Гидролиз разрушает белки до низкомолекулярных продуктов, поэтому его используют для ускорения усвояемости белков (спортивное питание), снижения аллергических реакций (детское питание, в особенности молочные смеси), получения аминокислот.
Примеры решения задач
ПРИМЕР 1
Белки - природные полипептиды с огромной молекулярной массой. Они входят в состав всех живых организмов и выполняют различные биологические функции.
Строение белка.
У белков существует 4 уровня строения:
- первичная структура белка - линейная последовательность аминокислот в полипептидной цепи, свернутых в пространстве:
- вторичная структура белка - конформация полипептидной цепи, т.к. скручивание в пространстве за счет водородных связей между NH и СО группами. Есть 2 способа укладки: α -спираль и β - структура.
- третичная структура белка - это трехмерное представление закрученной α -спираль или β -структуры в пространстве:

Эта структура образуется за счет дисульфидных мостиков -S-S- между цистеиновыми остатками. В образовании такой структуры участвуют противоположно заряженные ионы.
- четвертичная структура белка образуется за счет взаимодействия между разными полипептидными цепями:

Синтез белка.
В основе синтеза лежит твердофазный метод, в котором первая аминокислота закрепляется на полимерном носителе, а к ней последовательно подшиваются новые аминокислоты. После полимер отделяют от полипептидной цепи.
Физические свойства белка.
Физические свойства белка определяются строением, поэтому белки делят на глобулярные (растворимые в воде) и фибриллярные (нерастворимые в воде).
Химические свойства белков.
1. Денатурация белка (разрушение вторичной и третичной структуры с сохранением первичной). Пример денатурации - свертывание яичных белков при варке яиц.
2. Гидролиз белков - необратимое разрушение первичной структуры в кислом или щелочном растворе с образованием аминокислот. Так можно установить количественный состав белков.
3. Качественные реакции:
Биуретовая реакция - взаимодействие пептидной связи и солей меди (II) в щелочном растворе. По окончанию реакции раствор окрашивается в фиолетовый цвет.
Ксантопротеиновая реакция - при реакции с азотной кислотой наблюдается желтое окрашивание.
Биологическое значение белка.
1. Белки - строительный материал, из него построены мышцы, кости, ткани.
2. Белки - рецепторы. Передают и воспринимают сигнал, поступающих от соседних клеток из окружающей среды.
3. Белки играют важную роль в иммунной системе организма.
4. Белки выполняют транспортные функции и переносят молекулы или ионы в место синтеза или накопления. (Гемоглобин переносит кислород к тканям.)
5. Белки - катализаторы - ферменты. Это очень мощные селективные катализаторы, которые ускоряют реакции в миллионы раз.
Есть ряд аминокислот, которые не могут синтезироваться в организме - незаменимые , их получают только с пищей: тизин, фенилаланин, метинин, валин, лейцин, триптофан, изолейцин, треонин.
Гидролиз (гидролизация) белков – это процесс дробления цепочек белковых молекул на части.
Получаемые фрагменты называются и обладают рядом полезных свойств. Главное из которых – намного более быстрое усвоение по сравнению с первоначальной молекулой. Идеальный гидролиз белков – это расщепление молекулы белка до составляющих аминокислот. Именно они и ложатся в основу аминокислотных комплексов – самых эффективных препаратов с точки зрения снабжения мышечных клеток строительным материалом. Однако далеко не всегда имеет смысл проводить полный цикл гидролиза. Для улучшения скорости усвоения и повышения протеинов достаточно провести частичный гидролиз белка. В итоге исходная молекула распадается на цепочки по несколько аминокислот, которые называются ди- и три-пептидами.
Процесс гидролиза белков
Еще в конце 19 века ученые установили, что белки состоят из меньших частиц – аминокислот. И именно с того времени началось изучение как аминокислот так и способов выделения их из структуры белка. В которой аминокислоты скреплены не хаотично, а находятся в определенной ДНК последовательности. Для организма человека эта последовательность не играет роли. Организму нужны только аминокислоты, «извлечь» которые задача пищеварительной системы. В процессе пищеварения организм дробит белки до отдельных аминокислот, которые и попадают в кровь. Однако в зависимости от сотни факторов эффективность пищеварения далека от 100%. Исходя из процента усвоенных в процессе пищеварения веществ оценивают пищевую ценность того или иного продукта. Гидролиз способен многократно повысить пищевую ценность белков. Он не является противопоставлением таким процессам получения белка как . Гидролиз – это процесс вторичной обработки уже выделенного тем или иным способом белка.
Сырьем для гидролиза выступает уже частично обработанное молоко. Как правило, берется наиболее дешевый молочный белок. Учитывая дальнейшую обработку и конечный итог – не имеет смысла брать более дорогие ингредиенты, такие как сывороточный белок или изолят. Для медицинских целей в гидролизе может использоваться и кровь животных, однако в спортивной промышленности она неприменима. Основными способами гидролизации молочных белков являются кислотный гидролиз и энзимный гидролиз .
Кислотный гидролиз
Суть данного процесса в обработке исходного сырья определенными кислотами. Белок обрабатывают соляной кислотой и нагревают примерно до 105-110 °С. В таком состоянии его выдерживают в течение суток. В результате молекулярные связи рвутся и белки распадаются на отдельные аминокислоты. Кислотный гидролиз наиболее простой и дешевый в осуществлении. Однако он предъявляет крайне высокие требования к соблюдению технологии и главное – качеству и точности дозировок реагентов. Используя не те кислоты или неправильные дозировки вместе с молекулярными связями можно разрушить и сами аминокислоты. Как следствие, конечный продукт будет иметь неполный аминокислотный спектр. А остатки солей и кислот вряд ли положительно скажутся на пищеварении.
Энзимный (ферментативный) гидролиз
Энзимный гидролиз белков в чем-то повторяет естественный процесс пищеварения. Исходное сырье (как правило – ) смешивают с ферментами, которые осуществляют «пищеварение» белка и обеспечивают его распад до аминокислот. И именно этот метод чаще всего используют в спортивной индустрии. Энзимный (ферментативный) гидролиз белков менее требователен к соблюдению технологий. Излишки ферментов удалить проще и они не несут такого вреда как кислоты.
На первом этапе ферментного гидролиза сырье подвергают легкой температурной обработке. В итоге белок частично денатурирует (разрушается). После чего полученную фракцию смешивают с ферментами, которые завершают процесс гидролиза.

Использование гидролиза белков в спортивном питании
Гидролиз белков – это настоящая находка и спасение для индустрии . Благодаря нему можно не только получить чистые аминокислотные комплексы, но и значительно повысить эффективность обычных протеинов и гейнеров. Многие даже специально обрабатывают отдельные препараты ферментами. В результате такой частичной гидролизации белка у него повышается скорость усвоения. А так же решаются многие проблемы с индивидуальной непереносимостью компонентов молочного белка. На некоторых товарах можно даже встретить упоминание о присутствии в них пищеварительных энзимов. В каких-то протеинах – это обычные пищеварительные ферменты, которые начинают работать только в желудке. А в некоторых – это остатки процесса энзимного гидролиза. В любом случае усваиваются такие протеины намного быстрее и качественней.
В теории - прием гидролизованного протеина можно заменить приемом простого протеина в комплексе с пищеварительными ферментами (типа фестала, мезима форте и т.п.). Это будет значительно дешевле. Однако раздельный прием молочного белка и ферментов не столь эффективен. Вы никогда не сможете точно определить нужную дозировку ферментов. Их избыток вряд ли будет полезен вашему организму. Недостаток – гидролиз белков будет лишь частичным.
Польза и вред гидролиза белков
Гидролиз белков применяют в следующих случаях:
- Для ускорения усвояемости белка
- Для снижения аллергических реакций
- Для получения аминокислот в чистом виде
Особенно стоит отметить вопросы аллергических реакций. Пищевая аллергия не редкость в наше время, непереносимость продуктов или их отдельных компонентов встречается достаточно регулярно. Как пример – непереносимость лактозы. Пищевая аллергия – это реакция на специфические белки, содержащиеся в продуктах. При гидролизе эти белки разрушаются до пептидов. Которые являются лишь фрагментами белков и уже не вызывают аллергических реакций. Особенно стоит отметить, что пищевая ценность получаемых смесей ни в чем не уступает пищевой ценности исходного сырья.
Из недостатков гидролиза стоит отметить уничтожение полезных бактерий. Несмотря на то, что многие компании заявляют о присутствии бифидобактерий надо быть объективным – гидролиз их уничтожает. И бифидобактерии могут присутствовать только при внесении их извне. Впрочем, если речь идет о спортивном питании, то на первом месте здесь все же именно пищевая ценность получаемой смести.
Белки — высокомолекулярные органические соединения, состоящие из остатков аминокислот, соединённых в длинную цепочку пептидной связью.
В состав белков живых организмов входит всего 20 типов аминокислот, все из которых относятся к альфа-аминокислотами, а аминокислотный состав белков и их порядок соединения друг с другом определяются индивидуальным генетическим кодом живого организма.
Одной из особенностей белков является их способность самопроизвольно формировать пространственные структуры характерные только для данного конкретного белка.
Из-за специфики своего строения белки могут обладать разнообразными свойствами. Например, белки, имеющие глобулярную четвертичную структуру, в частности белок куриного яйца, растворяются в воде с образованием коллоидных растворов. Белки, обладающие фибриллярной четвертичной структурой в воде не растворяются. Фибриллярными белками, в частности, образованы ногти, волосы, хрящи.
Химические свойства белков
Гидролиз
Все белки способны вступать в реакцию гидролиза. В случае полного гидролиза белков образуется смесь из α -аминокислот:
Белок + nH 2 O => смесь из α-аминокислот
Денатурация
Разрушение вторичной, третичной и четвертичной структур белка без разрушения его первичной структуры называют денатурацией. Денатурация белка может протекать под действием растворов солей натрия, калия или аммония – такая денатурация является обратимой:
Денатурация же протекающая под действием излучения (например, нагрева) или обработке белка солями тяжелых металлов является необратимой:
Так, например, необратимая денатурация белка наблюдается при термической обработке яиц в процессе их приготовления. В результате денатурации яичного белка его способность растворяться в воде с образованием коллоидного раствора исчезает.
Качественные реакции на белки
Биуретовая реакция
Если к раствору, содержащему белок добавить 10%-й раствор гидроксида натрия, а затем небольшое количество 1 %-го раствора сульфата меди, то появится фиолетовое окрашивание.
раствор белка + NаОН (10%-ный р-р) + СuSO 4 = фиолетовое окрашивание
Ксантопротеиновая реакция
растворы белка при кипячении с концентрированной азотной кислотой окрашиваются в желтый цвет:
раствор белка + HNO 3(конц.) => желтое окрашивание
Биологические функции белков
| каталитическая | ускоряют различные химические реакции в живых организмах | ферменты |
| структурная | строительный материал клеток | коллаген, белки клеточных мембран |
| защитная | защищают организм от инфекций | иммуноглобулины, интерферон |
| регуляторная | регулируют обменные процессы | гормоны |
| транспортная | перенос жизненно-необходимых веществ от одних частей организма к другим | гемоглобин переносит кислород |
| энергетическая | снабжают организм энергией | 1 грамм белка может обеспечить организм энергией в количестве 17,6 Дж |
| моторная (двигательная) | любые двигательные функции организма | миозин (мышечный белок) |
В процессе приготовления и кулинарной обработки пищи белки могут претерпевать разнообразные превращения.
Меланоидиновая реакция
Растворимые аминокислоты (глицин, аланин, аспарагин и др.) энергично реагируют с сахарами, имеющими свободную карбонильную группу (ксилоза, фруктоза, глюкоза, мальтоза). Меланоидиновая реакция идет наиболее легко при молярном соотношении между аминокислотами и сахарами 1:2.
Аминокислота реагирует с сахаром по следующей схеме:
CH 2 OH-(CHOH) 4 -COH + H 2 N-CH 2 -COOH --------
глюкоза глицин
---------- CH 2 OH-(CHOH) 4 -C-NH-CH 2 -COOH
Менее активно действуют слаборастворимые кислоты (цистин, тирозин). Меланоидиновая реакция сопровождается образованием промежуточных соединений: альдегидов, циклических группировок фурфурольного, а затем и пиррольного характера. Меланоидиновые реакции активируются при повышенных температурах, особенно в случае многократного подогрева.
В результате этой реакции происходит потемнение корки белого хлеба: при выпечке аминокислоты на поверхности хлеба реагируют с сахарами, образовавшимися в процессе брожения теста.
Меланоидины могут также образовываться в процессе хранения консервов.
Гидролиз белков
Он может происходить под влиянием ферментов, кислот или щелочей. Этим способом можно получить любую из аминокислот, входящую в состав белков. Практическое значение имеет гидролиз биомассы дрожжей,выращенных на углеводородсодержащем сырье, и включающей до 40 % белков. Сырьем для получения биомассы микробиологическим путем могут служить также диоксид углерода, спирт, парафины нефти, природный газ, отходы дерево-перерабатывающей промышленности. Полученные из белковых гидролизатов аминокислоты разделяют методами ионообменной хроматографии, электрофореза и газожидкостной хроматографии.
Гидратация белков
Белки связывают воду, т.е. проявляют гидрофильные свойства. При этом они набухают, увеличивается их масса и объем. Набухание белка сопровождается его частичным растворением. Гидрофильность отдельных белков зависит от их строения. Имеющиеся в их составе и расположенные на поверхности белковой макромолекулы гидрофильные -СО-NН- (пептидная связь), аминогруппы -NН 2 , карбоксильные -СООН- группы притягивают к себе молекулы воды, строго ориентируя их на поверхности молекулы.
Окружающие белковые глобулы гидратная (водная) оболочка препятствует агрегации, а следовательно, способствует устойчивости растворов белка и препятствуют его осаждению.
H 3 N + -(CH 2)n-COOH + NH 3 -(CH 2)n-COO - NH 2 -(CH 2)n-COO -
изоэлектрическая точка
рН=1,0 рН=7,0 рН=11,0
В изоэлектрической точке (см. схему) белки обладают наименьшей способностью связывать воду, происходит разрушение гидратной оболочки вокруг белковых молекул, поэтому они соединяются, образуя крупные агрегаты. При изменении рН среды молекула белка становится заряженной и его гидратационная способность меняется. При ограниченном набухании концентрированные белковые растворы образуют сложные системы, называемые студиями. Глобулярные белки могут полностью гидратироваться, растворяясь в воде (например, белки молока), образуя растворы с невысокой концентрацией.
Гидрофильные свойства белков, т.е. их способность образовывать студии, стабилизировать суспензии, эмульсии и пены имеют большое значение в пищевой промышленности. Различная гидрофильность клейковинных белков - один из признаков, характеризующих качество зерна пшеницы и получаемой из него муки (так называемые сильные и слабые пшеницы). Гидрофильность белков зерна и муки играет большую роль при хранении и переработке зерна, в хлебопечении. Тесто, которое получают в хлебопекарном производстве, при изготовлении мучных кондитерских изделий, представляет собой набухший в воде белок, концентрированный студень, содержащий зерна крахмала.